Μέρος Πρώτο
Επιστημονικό υπόβαθρο μέχρι τις παραμονές του Β΄ Παγκοσμίου Πολέμου
Στην Αρχαία Ελλάδα, μια ομάδα φιλοσόφων γνωστών ως ατομικοί, πίστευαν ότι ο κόσμος αποτελείται στην πραγματικότητα από μικροσκοπικά σωματίδια που ονομάζονται άτομα. Τη θεωρία των ατόμων τη διατύπωσε πρώτος ο Λεύκιππος ο Μιλήσιος και την ανέπτυξε ο μαθητής του, ο Δημόκριτος (~460 π.Χ. – 370 π.Χ.) από τα Άβδηρα της Θράκης.
Ό,τι γνωρίζουμε για τις ιδέες του Δημόκριτου προέρχεται από τα θραύσματα των σκέψεων του που άλλοι συγγραφείς όπως ο Αριστοτέλης, ο Θεόφραστος, ο Σέξτος ο Εμπειρικός, ο Αλέξανδρος από την Αφροδισιάδα, ο Ιωάννης Φιλόπονος, ο Σιμπλίκιος, παραθέτουν. Ο Δημόκριτος πίστευε πως στο Σύμπαν υπήρχαν πολλά άτομα, και πως υπήρχαν ανέκαθεν. Τα άτομα δεν μπορούσαν να τμηθούν περαιτέρω, ούτε να καταστραφούν. Αυτά τα «άφθαρτα», «αιώνια», και «αδιαίρετα» μικροσκοπικά σωματίδια συνδυάζονται και ανασυνδυάζονται για να δημιουργήσουν τον περίπλοκο Κόσμο που βλέπουμε και τις συνεχείς αλλαγές που παρατηρούμε. Με τα λόγια του Δημοκρίτου: « Κατά σύμβαση υπάρχει γλυκό και πικρό, ζεστό και κρύο… Στην πραγματικότητα υπάρχουν μόνο άτομα και το κενό » 1 .
Η ατομική θεωρία του Δημόκριτου γρήγορα περιέπεσε σε αφάνεια, επειδή ερχόταν σε αντίθεση με την αυθεντία του μεγάλου Έλληνα φυσικού φιλόσοφου Αριστοτέλη (384 – 322 π.Χ.) ο οποίος πρότεινε ότι τα βασικά συστατικά του Κόσμου θα πρέπει να αναζητηθούν στην οικεία ανθρώπινη κλίμακα των αντικειμένων που γίνονται αντιληπτά με τις αισθήσεις μας. Ο Σταγειρίτης φιλόσοφος υποστήριζε ότι τα βασικά είδη της ύλης, τα οποία ονόμαζε «στοιχεία», ήταν τέσσερα: το χώμα, το νερό, ο αέρας και η φωτιά. Καθένα από τα στοιχεία είχε τη φυσική του θέση 2 . Με το δεδομένο ότι υπήρχε μια τέτοια φυσική θέση, ήταν πολύ λογικό να υποθέσει κανείς ότι, όποτε ένα αντικείμενο βρισκόταν μακριά από τη φυσική του θέση, θα ξαναγύριζε σ’ αυτήν με την πρώτη ευκαιρία. Για παράδειγμα, μια πέτρα, που κρατάει κάποιος στον αέρα, δείχνει την «επιθυμία» της να επιστρέψει στη φυσική της θέση με τον τρόπο που «σπρώχνει» το χέρι προς τα κάτω. Θα μπορούσαμε λοιπόν να συμπεράνουμε ότι αυτός είναι ο λόγος που η πέτρα έχει βάρος. Αν την αφήσουμε από το χέρι μας, αμέσως η πέτρα κινείται προς τη φυσική της θέση και πέφτει προς τα κάτω 3 . Το τελικό συμπέρασμα της αριστοτελικής σκέψης είναι πως η κατάσταση της ηρεμίας, ή έλλειψης κινήσεως, είναι η φυσική κατάσταση των σωμάτων. Αυτή η θεωρία έμοιαζε να εξηγήσει τόσα πολλά, ώστε είχε γίνει αποδεκτή από όλους τους μεγάλους διανοητές και φυσικούς φιλοσόφους, μέχρι το τέλος του Μεσαίωνα! Θα καταρριφθεί από τον ιδρυτή της σύγχρονης Επιστήμης, τον Γαλιλαίο (1564-1642).
Χρειάστηκε να περάσουν περίπου 2,3 χιλιάδες χρόνια για να αναδειχθεί η ατομική εικόνα ως η βασική ιδέα των θετικών επιστημών. Χρειάστηκε να προηγηθεί πρώτα οι μεγάλες χημικές ανακαλύψεις του 18ου και κυρίως του 19ου αιώνα για να αποδειχθεί πόσο καρποφόρα ήταν η ατομική υπόθεση. Η επανεμφάνιση του ατόμου στην επιστημονική ορολογία σαν οντότητα, έγινε από τον Τζον Ντάλτον (1766-1844) έναν Άγγλο χημικό που ασχολήθηκε παράλληλα και με τη Φυσική και τη Μετεωρολογία. Ακόμα και σήμερα, ο ορισμός που διδάσκεται στα σχολεία της μέσης εκπαίδευσης, είναι εκείνος που αναφέρεται από τον Ντάλτον το 1808:
« Διάλεξα τη λέξη άτομο για να αποδώσει τα ελάχιστα σωματίδια, αντί για τις αντίστοιχες λέξεις σωματίδιο, μόριο ή οτιδήποτε άλλο, επειδή πιστεύω πως αυτή είναι πιο εκφραστική, αφού εμπεριέχει την έννοια της αδιαιρέτου την οποία οι άλλες δεν εμπεριέχουν. Μπορεί να φανεί ότι επεκτείνω αρκετά τον ορισμό όταν μιλάω για σύνθετα άτομα. Ονομάζω το στοιχειώδες σωματίδιο του ανθρακικού οξέος ως σύνθετο άτομο. Αυτό το άτομο, μπορεί φυσικά να διαιρεθεί, αλλά τότε δεν είναι πλέον άτομο ανθρακικού οξέος, αφού έχει αναλυθεί σε άνθρακα και οξυγόνο. Mε την έννοια αυτή θεωρώ ότι δεν υπάρχει ανακολουθία όταν αναφέρομαι σε σύνθετα άτομα και αυτό που εννοώ γίνεται σαφές.» 4 . Ο Ντάλτον θεωρούσε πως κάθε στοιχείο είχε ένα συγκεκριμένο είδος ατόμου διαφορετικό από τα άτομα κάθε άλλου στοιχείου. Αυτό σήμαινε ότι για τα περίπου 40 γνωστά τότε στοιχεία έπρεπε να υπάρχουν 40 διαφορετικά άτομα ως βασικά συστατικά σ’ όλα τα σώματα. Τέλος, τα μόρια τα χαρακτήριζε επίσης άτομα αλλά τα ονόμασε «σύνθετα άτομα» compound atoms, όρος που έχει παραμείνει ως σήμερα όπου όλοι αναφερόμαστε στις χημικές ενώσεις με τον όρο compound5 .
Στη συνέχεια, τη σημαντικότερη προσφορά στον τομέα της θεώρησης του ατόμου και μέσα από αυτό, ολόκληρης της χημικής επιστήμης, πραγματοποιεί ο Ρώσος χημικός Μεντελέγιεφ (1834-1907), ο οποίος έγραψε το εγχειρίδιο «Οι Αρχές της Χημείας» (δύο τόμοι, 1868-1870), βασισμένος στα δικά του πειράματα και στα μαθήματα που παρέδιδε στους φοιτητές του. Στην προσπάθειά του να κατανοήσει την εκτεταμένη γνώση που υπήρχε ήδη για τις χημικές και φυσικές ιδιότητες των χημικών στοιχείων και των ενώσεών τους, στηριζόμενος σε μία παλαιότερη ιδέα των Τζων Νιούλαντς και Γιούλιους Λόταρ Μέγιερ, κατέταξε το 1869, τα 70 στοιχεία που μέχρι τότε ήταν γνωστά, σε έναν πίνακα που περιλάμβανε έξι οριζόντιες και οκτώ κάθετες στήλες, όπως περίπου είναι τα σταυρόλεξα. Τοποθέτησε πρώτα τα στοιχεία κατά περιόδους στις οριζόντιες σειρές. Αυτό σημαίνει ότι τα στοιχεία μιας ορισμένης γραμμής παρουσιάζουν κανονική επανάληψη των χημικών ιδιοτήτων. Μετά κατέταξε τα στοιχεία των οριζοντίων γραμμών καθέτως, ώστε κάθε κάθετη στήλη να περιέχει στοιχεία που παρουσιάζουν κάπως όμοιες ιδιότητες. Τις κάθετες αυτές στήλες ονόμασε οικογένειες.
Με τον πίνακα αυτόν ο Μεντελέγιεφ προχώρησε στη διατύπωση του Περιοδικού Νόμου των χημικών στοιχείων σύμφωνα με τον οποίο οι χημικές ιδιότητες των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους βάρους. Ο πρωτοποριακός αυτός πίνακας περιείχε κενά σε ορισμένες θέσεις. Ο Μεντελέγιεφ εξήγησε ότι στα κενά αυτά θα έπρεπε να υπάρχουν κάποια στοιχεία, τα οποία δεν είχαν μέχρι τότε ανακαλυφθεί. Στην πραγματικότητα, από τον πίνακά του έλειπε μία ολόκληρη στήλη, όπως προβλεπόταν από τα σχετικά ατομικά βάρη. Χρόνια αργότερα η στήλη αυτή συμπληρώθηκε από αδρανή αέρια – τα «ευγενή» αέρια. Τις δεκαετίες του 1870 και του 1880 οι χημικοί ανακάλυψαν αρκετά ακόμη από τα στοιχεία που ο Μεντελέγιεφ είχε προβλέψει με βάση τον πίνακά του.
Οι χημικοί αν και μπορούσαν να χειριστούν τα άτομα στα εργαστήριά τους, δεν μπορούσαν να πουν πολλά πράγματα για το τι πραγματικά ήταν αυτές οι μονάδες ύλης. Κατά το μεγαλύτερο μέρος του δέκατου ένατου αιώνα, οι φυσικοί από την άλλη πλευρά, ενδιαφέρονταν μάλλον για άλλα πράγματα: για το πώς διατηρείται η ενέργεια, το πώς μπορούσαν να μετρηθούν ο ηλεκτρισμός και ο μαγνητισμός, για τη φύση της θερμότητας και το γιατί τα αέρια εκδήλωναν την παρατηρούμενη συμπεριφορά. Η θεωρία των φυσικών για τα αέρια -η κινητική θεωρία- έθετε επίσης ερωτήματα για τα άτομα και τα μόρια. Όμως οι φυσικοί, όπως και οι χημικοί, θεωρούσαν πως, μολονότι η ατομική θεωρία αποδεικνυόταν εξαιρετικά χρήσιμη για την εξήγηση των παρατηρήσεων και των μετρήσεών τους, η πραγματική φύση των ατόμων δύσκολα θα μπορούσε να κατανοηθεί.
Η πρώτη ένδειξη ότι τα άτομα δεν ήταν απλώς η μικρότερη μονάδα ύλης προήλθε από τη μνημειώδη ανακάλυψη ενός από τα συστατικά τους: του ηλεκτρονίου. Πειραματικά είχε ήδη δειχθεί ότι τα άτομα μπορούσαν να έχουν ηλεκτρικό φορτίο, διότι, με τη διέλευση ηλεκτρικού ρεύματος μέσα από κάποια διαλύματα, ορισμένα άτομα έλκονταν από τον θετικό πόλο και άλλα από τον αρνητικό. Οι φυσικοί δεν μπορούσαν να αποφανθούν για το εάν οι ηλεκτρικές ιδιότητες ενός ατόμου έπαιζαν κάποιο ρόλο στις χημικές αντιδράσεις. Όμως μέτρησαν τα ηλεκτρικά φορτία τους και διαπίστωσαν ότι λάμβαναν συγκεκριμένες τιμές, όλες τους πολλαπλάσιες ενός συγκεκριμένου φορτίου. Τα φορτία αυτά ονομάστηκαν «ηλεκτρόνια» το 1894, όταν ο Άγγλος φυσικός Τζόζεφ Τζων Τόμσον (1856-1940), είχε μόλις αρχίσει να χρησιμοποιεί στα πειράματά του στο Κέμπριτζ τον καθοδικό σωλήνα6.
Ο Τόμσον ήταν και ο πρώτος που επιχείρησε τον Μάρτιο του 1904, να απεικονίσει τη μορφή και το σχήμα των ατόμων, τώρα που είχε ανακαλύψει τα ηλεκτρόνια. Φαντάστηκε, λοιπόν, ότι τα άτομα έμοιαζαν με μικρές μπάλες στην εξωτερική επιφάνεια των οποίων ήταν σκόρπια κολλημένα τα ηλεκτρόνια, σαν τις σταφίδες σ’ ένα σφαιρικό σταφιδόψωμο7.

Τζόζεφ Τζων Τόμσον (1856-1940)
Ταυτόχρονα, ανακαλύψεις που σχετίζονταν με το περίεργο φαινόμενο της ραδιενέργειας άρχισαν επίσης να προωθούν την ατομική έρευνα. Το 1896, ο Γάλλος φυσικός Αντουάν Ανρί Μπεκερέλ (1852 – 1908), φυσικός τρίτης γενιάς, κατείχε – όπως και ο πατέρας και ο παππούς του πριν από αυτόν – στην έδρα Φυσικής στο Μουσείο Φυσικής Ιστορίας στο Παρίσι8, μελετούσε τον φωσφορισμό, δηλ. τη δευτερογενή ακτινοβολία που εκπέμπεται από ορισμένα σώματα σαν αποτέλεσμα της πρωτογενούς εκθέσεως τους σε ηλιακό φως (ή κάποια άλλη ακτινοβολία). Ήδη στα τέλη του 1895 ο επιστημονικός κόσμος αλλά και η κοινή γνώμη είχαν εντυπωσιασθεί από την ανακάλυψη των ακτίνων Χ από τον Ρέντγκεν. Οι ακτίνες Χ παράγονται όταν δέσμη ηλεκτρονίων μεγάλης ταχύτητας προσπέσει πάνω σε μέταλλο. Ήταν φυσικό για τον Μπεκερέλ να αναρωτηθεί μήπως οι ακτίνες Χ είχαν κάποια σχέση με τον φωσφορισμό. Έτσι δοκίμασε διάφορες φωσφορίζουσες ουσίες ελπίζοντας να παραγάγει με αυτές ακτίνες Χ. Παρά την αποτυχία του δεν απογοητεύθηκε. Αποφάσισε να δοκιμάσει την τύχη του με ορισμένες φωσφορίζουσες ενώσεις του μετάλλου ουρανίου (τις οποίες είχε παρασκευάσει ο ίδιος δεκαπέντε χρόνια νωρίτερα). Ούτε και σ’ αυτή την περίπτωση κατάφερε να παραγάγει ακτίνες Χ. Όμως ο Μπεκερέλ παρατήρησε πως το υλικό αυτό εξέπεμπε αυθόρμητα ακτινοβολία και συμπέρανε ότι η εκπομπή της ακτινοβολίας δεν εξαρτάται από το φως, αλλά είναι εγγενής ιδιότητα του ίδιου του ουρανίου. Τα επόμενα πειράματα έδειξαν ότι, πραγματικά, το ουράνιο εξέπεμπε πάντοτε ακτινοβολία. Και την εξέπεμπε με ένα σχεδόν σταθερό ρυθμό πρακτικά ανεξάρτητο από τις μεταβολές στο περιβάλλον σαν να υπήρχε κάποιο ανεξάντλητο απόθεμα ενέργειας: «κανείς δεν έχει βρει ακόμα» έγραφε ο Μπεκερέλ το 1896 «από που αντλεί το ουράνιο την ενέργεια που εκπέμπει με τέτοια επιμονή». Αρχικά, ο Μπεκερέλ δεν έδωσε σε αυτή την ακτινοβολία συγκεκριμένο όνομα. Μιλούσε απλώς για «αόρατες ακτίνες». Ο ίδιος απέφευγε την ερμηνεία, σύντομα όμως ονομάστηκαν «ακτίνες ουρανίου» ή «ακτίνες Μπεκερέλ».
Και μετά ήλθε η Μαρία Κιουρί (1867-1934) που βρήκε το 1898, ότι και το θόριο εκπέμπει ακτινοβολία σαν αυτή του ουρανίου και πρότεινε την ιδέα ότι η νέα αυτή ακτινοβολία μπορεί να χρησιμεύσει για την ανακάλυψη άγνωστων ακόμη στοιχείων. Έτσι σε συνεργασία με τον άνδρα της Πέτρο Κιουρί (1859-1906), στις 18 Ιουλίου του 1898 ανακοινώνουν στην επιστημονική κοινότητα την ανακάλυψη ενός νέου στοιχείου, που ονομάστηκε Πολώνιο, προς τιμήν της πατρίδας της Μαρίας Κιουρί. Στις 26 Δεκεμβρίου του ίδιου έτους αναγγέλλεται από το ζεύγος Κιουρί η ανακάλυψη και του ραδίου. Και τα δυο τους εξέπεμπαν τη νέα αυτή ακτινοβολία με πολύ πιο έντονο ρυθμό απ’ ό,τι το ουράνιο. Η αυθόρμητη εκπομπή ακτινοβολίας από το ράδιο ήταν μάλιστα τόσο έντονη που η Μαρία Κιουρί πρότεινε την αλλαγή του ονόματος από «ακτίνες ουρανίου» ή «ακτίνες Μπεκερέλ» σε «ραδιενέργεια», η οποία περιγράφει τη φυσική ιδιότητα ορισμένων στοιχείων να εκπέμπουν αόρατη, διεισδυτική ακτινοβολία, χωρίς να απαιτείται εξωτερική διέγερση. Ο όρος καθιερώθηκε ταχύτατα στην επιστημονική κοινότητα και αντικατέστησε προηγούμενες ονομασίες9.
Η επιστημονική έρευνα δεν άργησε να αποκαλύψει ότι το ουράνιο και το θόριο εκπέμπουν τριών ειδών ακτινοβολίες, με διακριτικό κριτήριο την επίδραση του μαγνητικού πεδίου στην πορεία της διάδοσής τους. Συγκεκριμένα, μέρος της ακτινοβολίας καμπυλώνεται ελαφρά κατά μια διεύθυνση, όταν περνάει μέσα από ένα μαγνητικό πεδίο. Ένα άλλο μέρος της ακτινοβολίας καμπυλώνεται κατά την αντίθετη διεύθυνση αλλά σε πολύ μεγαλύτερο βαθμό, ενώ το υπόλοιπο της ακτινοβολίας μοιάζει να παραμένει ανεπηρέαστο από το μαγνητικό πεδίο καθώς εξακολουθεί να διαδίδεται σε ευθεία γραμμή.
Ο μόλις είκοσι επτά ετών, Νεοζηλανδός επιστήμονας Έρνεστ Ράδερφορντ (1873-1937), ένας πρώην φοιτητής του Τόμσον, το 1899, μελετώντας στο Εργαστήριο Κάβεντις, τις ακτινοβολίες που εκπέμπονταν από το ουράνιο και το θόριο, ονόμασε τις δύο πρώτες ακτινοβολίες με τα δύο πρώτα γράμματα του ελληνικού αλφάβητου. Έτσι, η ακτινοβολία που παρουσιάζει μικρή καμπυλότητα, ονομάστηκε ακτινοβολία α (άλφα) ή ακτίνες α. Οι ακτίνες άλφα αποδείχτηκε ότι είναι σωματιδιακής φύσης. Κάθε σωματίδιο έχει μάζα τετραπλάσια από εκείνη του ατόμου του υδρογόνου και φορτίο διπλάσιο εκείνου του ηλεκτρονίου, με αντίθετο όμως από αυτό πρόσημο. Άρα, το σωματίδιο άλφα είναι ένας πυρήνας ηλίου, όπως σωστά προσδιόρισε το 1908, ο Ράδερφορντ. Εκείνη η ακτινοβολία που παρουσιάζει μεγάλη καμπυλότητα, ονομάστηκε ακτινοβολία β (βήτα) ή ακτίνες β. Οι ακτίνες βήτα αποδείχτηκε ότι είναι ταυτόσημες με τις καθοδικές ακτίνες. Είναι, δηλαδή, ένα ρεύμα ηλεκτρονίων από τα οποία το καθένα έχει μάζα ίση με το 1/1837 της μάζας του ατόμου του υδρογόνου και φορτίο ίσο με -1. Το 1900, ο Μπεκερέλ ήταν ο πρώτος που συνειδητοποίησε ότι οι ακτίνες β και τα ηλεκτρόνια ήταν το ίδιο πράγμα. Αργότερα ένας Γάλλος, ο Πωλ Ουλρίκ Βιλλάρ, ανακάλυψε την τρίτη ακτινοβολία, που παραμένει ανεπηρέαστη από το μαγνητικό πεδίο και ακολουθώντας την ονοματοδοσία του Ράδερφορντ, την ονόμασε ακτινοβολία γ (γάμα) ή ακτίνες γ10. Οι ακτίνες γάμα είναι πράγματι, με την κλασική έννοια, ακτίνες. Πρόκειται για ηλεκτρομαγνητική ακτινοβολία, «φως», παρόμοια με εκείνη των ακτινών Χ, αλλά με μικρότερο μήκος κύματος και μεγαλύτερη διεισδυτικότητα από αυτές.
Την ίδια χρονιά, ο Ράδερφορντ άρχισε να συνενώνει όλες αυτές τις πληροφορίες σε ένα συνεκτικό σύνολο, με τη βοήθεια του αριστούχου απόφοιτου Χημείας (1898), από το Κολέγιο Μέρτον του Πανεπιστημίου της Οξφόρδης, Φρέντερικ Σόντυ. Οι δύο τους, το 1902, αντιλήφθηκαν ότι η συμπεριφορά των ραδιενεργών στοιχείων οφειλόταν στη διάσπασή τους σε άλλα στοιχεία. Η διάσπαση αυτή εξέπεμπε ακτινοβολία α, β και γ. Όταν ανακαλύφθηκε η ραδιενέργεια, κανείς δεν γνώριζε ποια ήταν η αιτία της. Χρειάσθηκε προσεκτική έρευνα από τον Ράδερφορντ για να αποδειχθεί ότι η πυρηνική μεταστοιχείωση, δηλαδή η μετατροπή ενός χημικού στοιχείου σε κάποιο άλλο στοιχείο, συνέβαινε στην πραγματικότητα11.
Τα κύρια σημεία της θεωρίας αυτής είναι τα εξής: Οι ραδιενεργές ουσίες περιέχουν ασταθή (δηλ. θνητά) άτομα. Ένα καθορισμένα ποσοστό των ατόμων αυτών διασπάται ανά μονάδα χρόνου. Το νέο άτομο που απομένει μετά τη διάσπαση είναι είτε σταθερό (δηλ. συνηθισμένο άτομο) είτε ραδιενεργό στη δεύτερη περίπτωση το νέο άτομο διασπάται ξανά, κοκ, μέχρι να καταλήξει τελικά σε σταθερό άτομο. «Σύμφωνα με την εικόνα αυτή» — έγραφε ο Ράδερφορντ- «η συνεχής εκπομπή ενέργειας από τα ραδιενεργά σώματα προέρχεται από την εσωτερική ενέργεια που είναι αποθηκευμένη στο άτομο και με κανένα τρόπο δεν έρχεται σ’ αντίθεση με το νόμο διατήρησης της ενέργειας». Και πρόσθεσε: «Η λανθάνουσα ενέργεια η κρυμμένη μέσα στο άτομο πρέπει να είναι τεράστια σε σύγκριση με την ενέργεια που εκλύεται κατά τις χημικές αντιδράσεις. Και δεν υπάρχει λόγος να υποθέτουμε ότι αυτό το τεράστιο απόθεμα ενέργειας υπάρχει μόνο στα ραδιενεργά στοιχεία. Φαίνεται ότι πιθανόν υπάρχει σ’ όλα τα στοιχεία, παρόλο που η σταθερότητά τους εμποδίζει τη διαπίστωση της ύπαρξής του»12.
Με τη σειρά τους το 1903 ο Πέτρος Κιουρί και ο Λαμπόρντ μέτρησαν για πρώτη φορά ποσοτικά την ενέργεια που εκλύεται από το ράδιο. Βρήκαν ότι ένα κιλό ράδιο εκπέμπει ενέργεια με ρυθμό 110 βατ. Μετέπειτα μελέτες έδειξαν ότι το ραδόνιο με την ακτινοβολία του εκλύει ένα εκατομμύριο φορές περισσότερη ενέργεια απ’ ό,τι ίσος όγκος υδρογόνου και οξυγόνου όταν ενώνονται εκρηκτικά για να φτιάξουν νερό. Τέλος ο Μπραγκ το 1904 μέτρησε έμμεσα την κινητική ενέργεια (και επομένως και την ταχύτητα) των σωματιδίων α, που αποτελούν ένα συστατικό της ακτινοβολίας των ραδιενεργών ουσιών. Η τιμή που προέκυψε ήταν τεράστια: γύρω στα 15 000 χιλιόμετρα το δευτερόλεπτο (περίπου 5% της ταχύτητας του φωτός). Η ταχύτητα αυτή αντιστοιχεί σε κινητική ενέργεια περίπου 5 εκατομμυρίων ηλεκτρονιοβόλτ ανά σωματίδιο α, μια τιμή που είναι ένα εκατομμύριο φορές μεγαλύτερη από την τυπική ενεργειακή τιμή ενός χημικού δεσμού.
Το μεγάλο μυστήριο λοιπόν ήταν αυτός ο τεράστιος παράγοντας του ενός εκατομμυρίου: Γιατί κατά τις ραδιενεργές μετατροπές να εκλύεται ενέργεια (ανά άτομο) εκατομμύρια φορές περισσότερη απ’ ό,τι κατά τις χημικές αντιδράσεις; Είναι δυνατόν να είναι αποθηκευμένη μέσα σε κάθε άτομο τόσο τεράστια ενέργεια; Και αν ναι, τι την εμποδίζει να εκδηλωθεί και στις χημικές αντιδράσεις; Μήπως τελικά υπάρχει πράγματι κάποια μυστηριώδης εξωτερική πηγή ενέργειας που τα ραδιενεργά υλικά έχουν την ικανότητα να συλλαμβάνουν και να μας την αποδίδουν υπό μορφή ακτινοβολίας; Ο ίδιος ο Ράδερφορντ είχε κλονισθεί: Το 1911 διατυπώνει την άποψη ότι η θεωρία της μεταστοιχείωσης αφήνει ανοικτό το θέμα εάν η τεράστια αυτή ενέργεια προέρχεται από το εσωτερικό των ραδιενεργών ατόμων ή από κάποια άλλη μυστηριώδη εξωτερική πηγή. Θα δούμε αργότερα ποια είναι η απάντηση στο ερώτημα αυτό13.
Ο Ράδερφορντ προσπάθησε επίσης να ελέγξει το μοντέλο του σταφιδόψωμου του Τόμσον και διηύθυνε, το 1909, το περίφημο πείραμα σκέδασης του συναδέλφου του, Χανς Γκάιγκερ και του μαθητή του, Έρνεστ Μάρσντεν (πείραμα Geiger-Marsden). Στο πείραμα αυτό, στα Φυσικά Εργαστήρια του Πανεπιστημίου του Μάντσεστερ, τα σωματίδια α, δηλαδή οι πυρήνες του στοιχείου Ήλιον (Ηe), χρησιμοποιήθηκαν σαν το εργαλείο συστηματικής διερεύνησης της ατομικής δομής με τη μελέτη της σκέδασής τους κατά το πέρασμά τους από ένα λεπτό φύλλο χρυσού.
Μια μέρα, αρχές του 1909, ο Ράδερφορντ μπήκε στο δωμάτιο όπου ο Μάρσντεν έκανε τις μετρήσεις του και του είπε: «Κοίταξε μήπως μερικά σωματίδια α ανακλώνται από τη μεταλλική επιφάνεια προς τα πίσω». Είναι περίεργο γιατί ο Ράδερφορντ θέλησε να κάνει αυτό τον έλεγχο μια και κανείς δεν περίμενε να υπάρχει τέτοια προς τα πίσω ανάκλαση των σωματιδίων α. Και όμως υπήρξε! Όταν το πληροφορήθηκε ο Ράδερφορντ έμεινε εμβρόντητος. «Ήταν το πιο απίστευτο γεγονός που μούτυχε στη ζωή μου», είπε αργότερα. «Ήταν σχεδόν τόσο απίστευτο, όσο και το να βάλεις με μια οβίδα 15 ιντσών σ΄ ένα φύλλο χαρτιού και να γυρίσει να σε χτυπήσει»14. Τα εργαστηριακά δεδομένα έδειξαν ότι το θετικό φορτίο ήταν συγκεντρωμένο σε έναν πολύ μικρό χώρο στο κέντρο του ατόμου, όπου ήταν συγκεντρωμένη και σχεδόν όλη η μάζα του. Επειδή τα αποτελέσματα της σκέδασης σωματιδίων α δεν μπορούν να εξηγηθούν από το ατομικό μοντέλο του Τόμσον, το «μοντέλο του σταφιδόψωμου» εγκαταλείφθηκε ως εσφαλμένο και διαψεύσθηκε ολοκληρωτικά το 1911. Εκείνη τη χρονιά ο Ράδερφορντ δημοσίευσε το θεμελιώδες επιστημονικό του άρθρο με τίτλο: «Η σκέδαση των σωματιδίων άλφα και βήτα από την ύλη και η δομή του ατόμου»15 στο οποίο παρουσίασε την ανάλυση των αποτελεσμάτων από το πείραμα Γκάιγκερ – Μάρσντεν. Ο Ράδερφορντ διατύπωσε την υπόθεση ότι τα ηλεκτρόνια περιφέρονται γύρω από τον πυρήνα του ατόμου, κατά τρόπο παρόμοιο με την περιφορά των πλανητών γύρω από τον ήλιο, διαψεύδοντας το μοντέλο του σταφιδόψωμου. Σύμφωνα με το πλανητικό μοντέλο του Ράδερφορντ: α) Σε κάθε άτομο υπάρχει θετικό φορτίο συγκεντρωμένο σε μια πολύ μικρή περιοχή του που είναι συμπαγής στον πυρήνα (αν και ο Ράδερφορντ δε χρησιμοποίησε πρώτος τον όρο «πυρήνας» στη δημοσίευσή του, αλλά ο Τζων Νίκολσον, επίσης το 1911)· β) Γύρω από τον πυρήνα βρίσκονται σε τροχιές τα αρνητικά ηλεκτρόνια, δεχόμενα από τον πυρήνα ελκτικές ηλεκτρικές δυνάμεις Κουλόμπ (Coulomb), σχηματίζοντας ένα σύννεφο αρνητικού φορτίου· γ)Ο μεγαλύτερος χώρος του ατόμου είναι κενός16.

Το πλανητικό μοντέλο του Ράδερφορντ ήταν επαναστατικό, αλλά παρουσίαζε σημαντικές θεωρητικές αδυναμίες: 1. Ασυμβατότητα με τον Ηλεκτρομαγνητισμό. Σύμφωνα με τους νόμους του Μάξγουελ: Ένα φορτισμένο σωματίδιο (όπως το ηλεκτρόνιο), όταν επιταχύνεται (π.χ. κινείται κυκλικά γύρω από τον πυρήνα), εκπέμπει ηλεκτρομαγνητική ακτινοβολία. Συνεπώς, το ηλεκτρόνιο θα έπρεπε να χάνει συνεχώς ενέργεια και να πέφτει σπειροειδώς στον πυρήνα μέσα σε απειροελάχιστο χρόνο. Άρα το άτομο θα έπρεπε να είναι ασταθές, κάτι που δεν συμβαίνει στη φύση. 2. Δεν εξηγούσε τα ατομικά φάσματα: Σύμφωνα με το μοντέλο του Ράδερφορντ, το ηλεκτρόνιο μπορούσε να έχει οποιαδήποτε τροχιά και οποιοδήποτε ποσό ενέργειας. Όμως στην πραγματικότητα, το φάσμα του υδρογόνου (και των απλών στοιχείων) είναι διακριτό – εκπέμπει φως μόνο σε συγκεκριμένα μήκη κύματος, όχι σε συνεχές φάσμα. Αυτό δεν μπορούσε να εξηγηθεί από το πλανητικό μοντέλο. 3. Δεν υπήρχε εξήγηση για τη σταθερότητα των τροχιών: Το μοντέλο δεν έδινε κανέναν φυσικό μηχανισμό για το γιατί ένα ηλεκτρόνιο παραμένει σε συγκεκριμένη τροχιά χωρίς να χάνει ενέργεια.
Ο Ράδερφορντ, εκτός των άλλων, διακρινόταν για την ικανότητά του να ανακαλύπτει εξαιρετικούς φοιτητές και συνεργάτες, πολλοί από τους οποίους κέρδισαν αργότερα τα δικά τους βραβεία Νόμπελ. Ένας από αυτούς ήταν ο Δανός Νιλς Μπορ (1885-1962), ο οποίος συνδύασε τις ατομικές ιδέες του καθηγητή του Ράδερφορντ, με την κβαντική θεωρία του Μαξ Μπλανκ, και κατάφερε να «σώσει» το πλανητικό μοντέλο και να δημιουργήσει το πρώτο σύγχρονο μοντέλο του ατόμου.

Στηριζόμενος στην ιδέα του Ράδερφορντ ότι σχεδόν όλη η μάζα του ατόμου είναι συγκεντρωμένη στον μικρό πυρήνα του και εφαρμόζοντας ένα συναρπαστικό νέο θεωρητικό εργαλείο που ονομαζόταν «κβαντική φυσική», ανέπτυξε το 1913 το λεγόμενο «άτομο του Μπορ». Στο μοντέλο του Μπορ το ατομικό βάρος, και συνεπώς η θέση του ατόμου στον περιοδικό πίνακα, οφειλόταν στο βάρος του θετικά φορτισμένου πυρήνα. Τα ηλεκτρόνια περιφέρονταν γύρω από τον πυρήνα διαγράφοντας διαφορετικές τροχιές, και εδώ ακριβώς υπεισέρχεται η «κβαντική» περιγραφή17. Για να άρει τις αδυναμίες του ατομικού προτύπου του Ράδερφορντ, ο Μπορ έθεσε αξιωματικά δύο προτάσεις που ονομάζονται και συνθήκες του Μπορ:
Πρώτη συνθήκη: Τα ηλεκτρόνια μπορούν να κινούνται γύρω από τον πυρήνα μόνο σε ορισμένες κυκλικές τροχιές στις οποίες η ενέργειά τους είναι κβαντισμένη, δηλαδή δεν μπορούν να έχουν οποιαδήποτε τιμή ενέργειας, αλλά μόνο συγκεκριμένες, διακριτές τιμές. Οι τροχιές αυτές ονομάζονται επιτρεπτές τροχιές.
Δεύτερη συνθήκη: Όταν το ηλεκτρόνιο βρίσκεται στις επιτρεπτές τροχιές δεν ακτινοβολεί και έτσι η ενέργεια του παραμένει σταθερή. Ένα ηλεκτρόνιο εκπέμπει ακτινοβολία μόνο κατά την μετάβασή του από μία επιτρεπτή τροχιά ψηλότερης ενέργειας σε μια επιτρεπτή τροχιά χαμηλότερης ενέργειας. Η ενέργεια του εκπεμπόμενου φωτονίου (Ε) ισούται τότε με τη διαφορά ενεργειών των δύο επιτρεπτών τροχιών. Κατά τον ίδιο τρόπο ένα ηλεκτρόνιο απορροφά ενέργεια μόνο κατά την μετάβασή του από μια επιτρεπτή τροχιά χαμηλότερης ενέργειας σε μια επιτρεπτή τροχιά ψηλότερης ενέργειας. Για να μπορέσει το ηλεκτρόνιο να κάνει αυτή τη μετάβαση πρέπει να του δοθεί ενέργεια (Ε) ακριβώς ίση με τη διαφορά ενεργειών των δύο τροχιών.
Το ατομικό πρότυπο του Μπορ μπορεί να περιγράψει ικανοποιητικά το άτομο του υδρογόνου και άλλα παρόμοια με το υδρογόνο (υδρογονοειδή) σωματίδια όπως το He+ τα οποία έχουν ένα μόνο ηλεκτρόνιο καθώς και τα φάσματά τους, ωστόσο αδυνατεί να περιγράψει πιο σύνθετα από το υδρογόνο άτομα. Το ατομικό πρότυπο του Μπορ αποτελεί μόνο μία προσέγγιση της δομής του ατόμου της πολύ πιο ακριβούς κβαντικής θεωρίας18.
Την επόμενη χρονιά, ο Άγγλος φυσικός Χένρι Μόσλεϋ (1887 – 1915), άλλος ένας μαθητής του Ράδερφορντ επιβεβαίωσε πειραματικά αυτό που είχε προτείνει ήδη το 1911, ο Αντόνιους Γιοχάνες βαν ντεν Μπρόεκ, ότι δηλαδή, η θέση κάθε στοιχείου στον περιοδικό πίνακα είναι ίση με το πυρηνικό του φορτίο. Ο Έρνεστ Ράδερφορντ, σε διάφορα άρθρα στα οποία ανέλυε την ιδέα του βαν ντεν Μπρόεκ, χρησιμοποίησε τον όρο «ατομικός αριθμός» για να αναφερθεί στη θέση ενός στοιχείου στον περιοδικό πίνακα. Κανένας συγγραφέας πριν από τον Ράδερφορντ δεν είναι γνωστό να χρησιμοποίησε τον όρο «ατομικός αριθμός» (συμβολίζεται με «Ζ») με αυτόν τον τρόπο, επομένως πιθανότατα αυτός καθιέρωσε αυτόν τον όρο.
Ο Μόσλεϋ χρησιμοποιώντας φάσματα ακτίνων Χ, έδειξε ότι αυτό που διαφοροποιεί μεταξύ τους τα άτομα δεν είναι παρά το μέγεθος του ηλεκτρικού φορτίου του πυρήνα τους, δηλαδή ο ατομικός τους αριθμός «Ζ» και ταξινόμησε τα στοιχεία στον Περιοδικό Πίνακα, όχι με βάση το ατομικό βάρος τους «Α», όπως είχε κάνει ο Μεντελέγιεφ, αλλά κατά σειρά αυξανόμενου ατομικού αριθμού Ζ. Για παράδειγμα, ο πυρήνας του ατόμου του υδρογόνου έχει ηλεκτρικό φορτίο +1. Γύρω από τον πυρήνα του υδρογόνου περιφέρεται ένα ηλεκτρόνιο με φορτίο -1. Τα ηλεκτρικά φορτία του πυρήνα και του ηλεκτρονίου αλληλοεξουδετερώνονται έτσι ώστε το άτομο στο σύνολο του να θεωρείται ως ηλεκτρικά ουδέτερο. Ανάλογα, ο πυρήνας του ηλίου έχει φορτίο +2 και περιβάλλεται από δυο ηλεκτρόνια που έχουν ολικό φορτίο -2. Ο πυρήνας του άνθρακα έχει φορτίο +6 και περιβάλλεται από έξι ηλεκτρόνια (συνολικό φορτίο ηλεκτρονίων -6). Ο πυρήνας του οξυγόνου έχει φορτίο +8 κι εξωτερικά φέρει οκτώ ηλεκτρόνια (συνολικό φορτίο ηλεκτρονίων -8). Ο πυρήνας του σιδήρου είναι πολύ μεγαλύτερος, έχει φορτίο +26 και περιβάλλεται από είκοσι έξι ηλεκτρόνια (συνολικό φορτίο ηλεκτρονίων -26). Σαν τελευταίο παράδειγμα, ο πυρήνας του ουρανίου έχει φορτίο +92 με ενενήντα δύο ηλεκτρόνια απ’ έξω (συνολικό φορτίο ηλεκτρονίων -92). Έτσι, λοιπόν, σύμφωνα μ’ όσα προηγούμενα αναφέρθηκαν, ο ατομικός αριθμός του υδρογόνου είναι 1, του ηλίου 2, του άνθρακα 6, του οξυγόνου 8, του σιδήρου 26 και του ουρανίου 9219. Μετά τον θάνατο του Μόσλεϋ το 1915, οι ατομικοί αριθμοί όλων των γνωστών στοιχείων, από το υδρογόνο μέχρι το ουράνιο (Z=92), εξετάστηκαν με τη μέθοδό του. Η εργασία του Μόσλεϋ, είπε ο Γάλλος χημικός Ζ. Υρμπέν «αποκατέστησε μια επιστημονική ακρίβεια στην κάπως ρομαντική ταξινόμηση του Μεντελέγιεφ.»20.
Υπήρχαν επτά στοιχεία (με Z<92) τα οποία δεν βρέθηκαν και επομένως αναγνωρίστηκαν ως ακόμη ανεξερεύνητα, που αντιστοιχούν στους ατομικούς αριθμούς 43, 61, 72, 75, 85, 87 και 91. Από το 1918 έως το 1947, ανακαλύφθηκαν και τα επτά από αυτά τα ελλείποντα στοιχεία. Μέχρι τότε, είχαν ανακαλυφθεί και τα πρώτα τέσσερα υπερουράνια στοιχεία, έτσι ώστε ο Περιοδικός Πίνακας να είναι πλήρης χωρίς κενά μέχρι το κιούριο ( Z=96). Εν τω μεταξύ ο Ράδερφορντ που διατύπωσε για πρώτη φορά το πυρηνικό πρότυπο του ατόμου (1911), συνέχισε να εργάζεται πάνω στη πυρηνική μεταστοιχείωση. Ενώ ο Ράδερφορντ από το 1902 υποστήριζε θεωρητικά ότι οι μεταστοιχειώσεις γίνονται αυθόρμητα στη φύση και μόνο στα ραδιενεργά στοιχεία, τελικά, μετά από μια μακρά σειρά σποραδικών πειραμάτων στο εργαστήριο του Κάβεντις, που διακόπηκαν από τον Α’ Παγκόσμιο Πόλεμο, θα καταφέρει, το 1919, την πρώτη τεχνητή μεταστοιχείωση «βομβαρδίζοντας» άτομα αζώτου με σωματίδια άλφα (δηλαδή πυρήνες του στοιχείου ήλιου) προερχόμενα από μία ραδιενεργό πηγή (ράδιο). ‘Έτσι προέκυψαν άτομα οξυγόνου με ταυτόχρονη απελευθέρωση ενός σωματιδίου υψηλής ενέργειας με θετικό φορτίο, το οποίο αποδείχθηκε ότι ήταν πυρήνας υδρογόνου21. Έκτοτε η μελέτη των πυρηνικών αντιδράσεων έγινε ένας κυρίαρχος τομέας της έρευνας. Ο ίδιος περιέγραψε την ανακάλυψή του με τον όρο «τεχνητή αποσύνθεση» (artificial disintegration), επειδή επρόκειτο για τεχνητή (και όχι φυσική) μεταβολή του πυρήνα – κάτι το ριζοσπαστικά νέο εκείνη την εποχή. Αυτό θεωρήθηκε η πρώτη τεχνητή πυρηνική αντίδραση, και ήταν η πρώτη φορά που άνθρωπος προκάλεσε την αλλαγή ενός στοιχείου σε άλλο – άρα και η πρώτη τεχνητή μεταστοιχείωση.
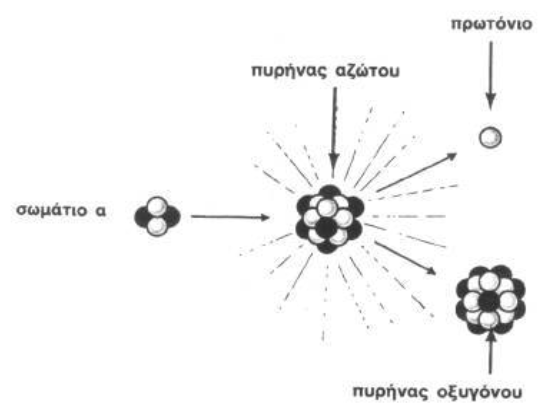
Τεχνητή μεταστοιχείωση αζώτου σε οξυγόνο. Πηγή: ΑΣΙΜΩΦ Ι., 1982, σ. 44
Ο Ράδερφορντ γνώριζε ότι το υδρογόνο ήταν το απλούστερο και ελαφρύτερο στοιχείο και επηρεάστηκε από την υπόθεση του Πράουτ (1815) ότι το υδρογόνο ήταν το δομικό στοιχείο όλων των στοιχείων. Η ανακάλυψη ότι ο πυρήνας υδρογόνου υπάρχει και σε άλλους πυρήνες ως στοιχειώδες σωματίδιο οδήγησε τον Ράδερφορντ να δώσει στον πυρήνα υδρογόνου H+ ένα ειδικό όνομα ως σωματίδιο, καθώς υποψιαζόταν ότι το υδρογόνο, το ελαφρύτερο στοιχείο, περιείχε μόνο ένα από αυτά τα σωματίδια. Έτσι όταν στη συνάντηση της Βρετανικής Ένωσης για την Προώθηση της Επιστήμης στο Κάρντιφ, στις 24 Αυγούστου 1920, ο Ράδερφορντ ρωτήθηκε από τον Όλιβερ Λοτζ, τι όνομα θα έδινε για τον θετικό πυρήνα υδρογόνου, για να αποφευχθεί η σύγχυση με το ουδέτερο άτομο υδρογόνου, εκείνος απάντησε «πρωτόνιο», ακολουθώντας τη λέξη «πρωτύλιο» του Πράουτ22.
Το 1908 ο Ράδερφορντ κέρδισε το βραβείο Νόμπελ, όχι όμως της Φυσικής, αλλά της Χημείας για τις πρωτοποριακές του έρευνες στον ραδιενεργό μετασχηματισμό των πυρήνων και στην απομόνωση των ακτινοβολιών άλφα και βήτα (πυρήνες ηλίου και ηλεκτρόνια, αντίστοιχα)23. Η βράβευσή του αυτή τον ενόχλησε κάπως επειδή θεωρούσε τον εαυτό του φυσικό, όχι χημικό. Ο Ράδερφορντ πίστευε ότι «όλη η επιστήμη είναι είτε φυσική είτε συλλογή γραμματοσήμων». Δεν υπήρξε ποτέ δεύτερο βραβείο για την ανίχνευση μεμονωμένων σωματιδίων άλφα, την αποκάλυψη της πυρηνικής δομής των ατόμων ή την ανακάλυψη του πρωτονίου. Αλλά λίγοι θα αμφέβαλλαν για την τεράστια συμβολή αυτού του γίγαντα της φυσικής και δικαίως θεωρείται ο πατέρας της Πυρηνικής Φυσικής. Ο δρόμος προς την ατομική βόμβα ουσιαστικά ξεκίνησε το 1919.

Όταν ο Ράδερφορντ ανέλαβε τη διεύθυνση του περίφημου εργαστηρίου Κάβεντις στο Κέμπριτζ (1919), πήρε μαζί του και τον πρώην μεταπτυχιακό φοιτητή του από το Μάντσεστερ, Τζέιμς Τσάντγουικ (1891 – 1974). Το 1923, μάλιστα ο Τσάντγουικ κατέλαβε τη θέση του αναπληρωτή διευθυντή ερευνών. Μαζί με τον Ράδερφορντ, βομβάρδισαν μια σειρά από ελαφρά στοιχεία με σωματίδια άλφα (πυρήνες ηλίου) και προκάλεσαν τεχνητές μεταστοιχειώσεις. Αλλά δεν μπορούσαν να διεισδύσουν στους πυρήνες των βαρύτερων στοιχείων, καθώς τα σωματίδια άλφα έχουν θετικό φορτίο και όταν πλησιάζουν έναν πυρήνα, υφίστανται ισχυρή ηλεκτροστατική απώθηση. Αυτή η ηλεκτροστατική απωστική δύναμη που βιώνουν δύο θετικά φορτισμένα σωματίδια (π.χ. πυρήνες ή πρωτόνια) καθώς πλησιάζουν σε πολύ μικρές αποστάσεις ονομάζεται φράγμα Κουλόμπ (Coulomb barrier)24. Για ελαφρά στοιχεία όπως το άζωτο ή το βόριο, η ενέργεια των φυσικών σωματιδίων άλφα (περίπου 5 μεγαηλεκτρονιοβόλτ – MeV)25 ήταν αρκετή για να προκαλέσει μεταστοιχείωση. Όμως για βαρύτερους πυρήνες (π.χ. σίδηρο, ουράνιο), το φράγμα Κουλόμπ είναι πολύ υψηλότερο – απαιτούνται δεκάδες MeV για να διεισδύσει ένα φορτισμένο σωματίδιο στον πυρήνα. Αυτή η «αδυναμία» των φυσικών σωματιδίων να υπερβούν το φράγμα Κουλόμπ στους βαρείς πυρήνες ήταν η πρωταρχική αιτία που οδήγησε τους φυσικούς να αναζητήσουν τεχνικούς τρόπους για να δώσουν περισσότερη ενέργεια στα σωματίδια και να κατασκευάσουν τους λεγόμενους επιταχυντές σωματιδίων26. Υπάρχουν δύο βασικοί τύποι επιταχυντών, οι γραμμικοί και οι κυκλικοί. Στον γραμμικό επιταχυντή τα σωματίδια επιταχύνονται πάνω σε μια ευθύγραμμη τροχιά, προσπίπτοντας στο στόχο τους.
Ο Rolf Widerøe ήταν ο πρώτος που, βασιζόμενος σε μία ιδέα του Γκούσταβ Ίσινγκ (1924), σχεδίασε στη διδακτορική διατριβή του, το 1927, ένα γραμμικό επιταχυντή και τον επόμενο χρόνο επέδειξε τη βασική αρχή της εναλλασσόμενης τάσης για επιτάχυνση φορτισμένων σωματιδίων, δημοσιεύοντας τα αποτελέσματα του πειράματός του με ιόντα Καλίου και Νατρίου, στο γερμανικό περιοδικό Archiv für Elektrotechnik. Το έργο του έγινε γνωστό και ενέπνευσε άλλους φυσικούς όπως τον Λόρενς (κύκλοτρον), τον Βαν ντε Γκράαφ (ηλεκτρογεννήτρια Βαν ντε Γκράαφ), τον Κόκροφτ και τον Γουόλτον (γεννήτρια Κόκροφτ-Γουόλτον).

Ο νεαρός πειραματικός φυσικός Έρνεστ Ορλάντο Λόρενς του Πανεπιστημίου του Μπέρκλεϊ, το 1929, διαβάζοντας το άρθρο του Widerøe εντυπωσιάστηκε από ένα διάγραμμα που απεικόνιζε μια συσκευή που παρήγαγε σωματίδια υψηλής ενέργειας μέσω μιας διαδοχής μικρών «ωθήσεων». Η συσκευή που απεικονιζόταν ήταν διατεταγμένη σε ευθεία γραμμή χρησιμοποιώντας ολοένα και μακρύτερα ηλεκτρόδια. Ο Λόρενς είδε ότι ένας τέτοιος επιταχυντής σωματιδίων σύντομα θα γινόταν πολύ μακρύς και δυσκίνητος για το πανεπιστημιακό του εργαστήριο. Σκεπτόμενος έναν τρόπο να κάνει τον επιταχυντή πιο συμπαγή, ο Λόρενς αποφασίσει να εγκαταστήσει έναν κυκλικό θάλαμο επιτάχυνσης μεταξύ των πόλων ενός ηλεκτρομαγνήτη. Το μαγνητικό πεδίο που συγκρατούσε τα φορτισμένα πρωτόνια σε μια σπειροειδή τροχιά καθώς επιταχύνονταν μεταξύ δύο μόνο ημικυκλικών ηλεκτροδίων συνδεδεμένων με εναλλασσόμενο δυναμικό. Μετά από εκατό στροφές περίπου, τα πρωτόνια που προσέκρουαν στον στόχο ως δέσμη σωματιδίων υψηλής ενέργειας. Ο Λόρενς είπε με ενθουσιασμό στους συναδέλφους του ότι είχε βρει μια μέθοδο για την απόκτηση ιδίων ιδιοτήτων πολύ υψηλής ενέργειας χωρίς τη χρήση υψηλής τάσης27 . Πρότεινε το σχεδιασμό ενός μηχανήματος το οποίο θα αντλούσε ενέργεια από τις σχετικά χαμηλές τάσεις των 25 000 βολτ για να επιταχύνει την κίνηση πρωτονίων μπρος και πίσω, σε ένα εναλλασσόμενο ηλεκτρικό πεδίο. Στη συνέχεια, ένας συνδυασμός ηλεκτρικών και μαγνητικών πεδίων θα επιταχύνει τα ίχνη κατά το πέρασμά τους από σωλήνες κενού που θα περιβάλλονταν από ηλεκτρομαγνήτες, ώστε να αναπτυχθούν όλο και μεγαλύτερη ταχύτητα διαγράφοντας μια σπείρα τροχιά. Δεν ήταν βέβαιος για το πόσο μεγάλος θα έπρεπε να είναι ο επιταχυντής προκειμένου να διαπεράσει την πυρήνα ενός ατόμου – αλλά ήταν πεπεισμένος που με αρκετά μεγάλο μαγνήτη και έναν αρκετά μεγάλο κυκλικό θάλαμο, θα μπορούσε να σπάσει το όριο του ενός εκατομμυρίου βολτ.
Στις αρχές του 1931, ο Λόρενς και οι συνεργάτες του, Μ. Στάνλεϊ Λίβινγκστον και Μίλτον Γουάιτ, είχαν κατασκευάσει τον πρώτο πρόχειρο επιταχυντή, ένα μηχάνημα με έναν μικρό θάλαμο διαμέτρου 11,4 εκατοστών, μέσα στο οποίο «κλότσαγε» πρωτόνια με τάση 80 000 βολτ. Ένα χρόνο αργότερα ο Λόρενς είχε ένα μηχάνημα 28 εκατοστών που ανέβαζε την τάση στο ένα εκατομμύριο βολτ. Ο Λόρενς, τώρα, ονειρεύτηκε να κατασκευάσει ακόμη μεγαλύτερους επιταχυντές, μηχανήματα που θα ζύγιζαν πολλές εκατοντάδες τόνους και θα κόστιζαν δεκάδες χιλιάδες δολάρια. Έμεινε ένα όνομα για την εφεύρεσή του, «κύκλοτρον», και έπεσε τον πρόεδρο του Πανεπιστημίου της Καλιφόρνιας, Ρόμπερτ Γκόρντον Στράουλ, να του παραχωρήσει ένα παλιό ξύλινο κτίριο δίπλα στο ΛεΚόντ Χολ, το κτίριο φυσικής που βρισκόταν ψηλά στην άκρη της. πανεπιστημιούπολης του Μπέρκλεϊ. Ο Λόρενς το βάφτισε «Εργαστήριο Ακτινοβολίας του Μπέρκλεϊ (BRL ή, απλώς, Rad Lab). Οι θεωρητικοί φυσικοί όλου του κόσμου σύντομα θα συνειδητοποιούσαν ότι αυτό που είχε δημιουργήσει ο Λόρενς στο «Rad Lab» του, θα τους επέτρεπε να κάνουν κάθε πλευρά του εσωτερικού των ατόμων 28 . Το 1939, ο Λόρενς τιμήθηκε με το Βραβείο Νόμπελ φυσικής για την εξέλιξη και την εξέλιξη του κυκλότρου και για τα αποτελέσματα που αποκτήθηκαν μέσω αυτού, κυρίως αυτά που τεχνητά ραδιενεργά στοιχεία 29 .
Οι επιταχυντές σωματιδίων, σχεδιασμένοι να βομβαρδίζουν με πρωτόνια και σωματίδια άλφα τους πυρήνες διαφόρων στοιχείων με σκοπό να πετύχουν τεχνητή μεταστοιχείωση, πετύχαιναν άμεσες προσκρούσεις σε πυρήνες περίπου μία φορά στο ένα εκατομμύριο προσπάθειες. Τα περισσότερα πρωτόνια και σωματίδια άλφα απλώς προσπερνούσαν τον πυρήνα-στόχο. Δεν προκαλεί έκπληξη, λοιπόν, ότι ο Ράδερφορντ, ο Αϊνστάιν και ο Μπορ θεωρούσαν τον βομβαρδισμό με σωματίδια χρήσιμο για την εμβάθυνση της γνώσης στη πυρηνική φυσική, αλλά απίθανο να ανταποκριθεί στις δημόσιες προσδοκίες για αξιοποίηση της ατομικής ενέργειας σε πρακτικές εφαρμογές στο εγγύς μέλλον. Σε μια διάλεξή του στο British Association for the Advancement of Science, το 1933, ο Ράδερφορντ χαρακτήρισε τέτοιες προσδοκίες «moonshine» δηλαδή «ανοησίες», («όνειρα θερινής νυκτός»). Ο Αϊνστάιν παρομοίασε τον βομβαρδισμό με το να πυροβολείς στο σκοτάδι σπάνια πουλιά, ενώ ο Μπορ συμφώνησε ότι οι πιθανότητες να τιθασευτεί η ατομική ενέργεια ήταν απειροελάχιστες. Συμφωνούσε με τον Ράδερφορντ ότι τα πειράματα ήταν πολύτιμα για την επιστήμη, αλλά χωρίς πρακτική προοπτική στο άμεσο μέλλον. Κι όμως ο Ράδερφορντ, ο Αϊνστάιν και ο Μπορ είχαν πέσει έξω στις προβλέψεις τους, και η απόδειξη δεν άργησε να έρθει. Όλα άλλαξαν με την ανακάλυψη του νετρονίου.
Τον Ιούνιο του 1930 οι Βάλτερ Μπότε (Walther Bothe) και Μπέκερ (H. Becker) ανακοίνωσαν ότι ο βομβαρδισμός του βηρυλλίου με ακτινοβολία άλφα έδινε πυρήνες άνθρακα συνοδευόμενους από μια εξαιρετικά διεισδυτική δευτερογενή ακτινοβολία, την οποία χαρακτήρισαν ως ακτινοβολία γάμμα. Ακολούθησε μια σημαντική δημοσίευση της Ειρήνης Κιουρί (Ι. Curie) και του Φρ. Ζολιό (F. Joliot) τον Ιανουάριο του 1932, όπου εξετάζεται πιο λεπτομερειακά η δευτερογενής αυτή ακτινοβολία από το βηρύλλιο χωρίς όμως να γίνει το αποφασιστικό βήμα και να εγκαταλειφθεί η αρχική πρόταση των Μπότε και Μπέκερ ότι η ακτινοβολία αυτή ήταν ηλεκτρομαγνητικής φύσεως. Στο Κέμπριτζ ο Τσάντγουικ όταν έμαθε για την εργασία των Ζολιό – Κιουρί, διαφώνησε με το συμπέρασμά της και με την ενθάρρυνση του Ράδερφορντ, πραγματοποίησε μια σειρά από πειράματα αποδεικνύοντας πως η υπόθεση της ακτινοβολίας γάμμα ήταν αβάσιμη30. Ο Τσάντγουικ υπέθεσε ότι η νέα αυτή ακτινοβολία αποτελούνταν από αφόρτιστα σωματίδια με μάζα παραπλήσια του πρωτονίου, και πραγματοποίησε μια νέα σειρά από πειράματα που αποδείκνυαν την υπόθεση του. Αυτά τα αφόρτιστα σωματίδια τα ονόμασε τελικά νετρόνια. Για την ανακάλυψή του αυτή ο Τσάντγουικ τιμήθηκε με το μετάλλιο Χιουζ (Hughes Medal) της Βασιλικής Εταιρείας (Royal Society) το 1932 (ήταν ήδη μέλος της από το 1927) και, το 1935 του απονεμήθηκε το Νόμπελ Φυσικής.
Έτσι, η έρευνα του Τσάντγουικ συνέβαλε στη διαλεύκανση του μυστήριου της συγκρότησης του πυρήνα. Από τότε, είναι πια γνωστό ότι ο πυρήνας είναι κατασκευασμένος από πρωτόνια και νετρόνια. Ξαναγυρνώντας στο παράδειγμα του ηλίου, ο πυρήνας του αποτελείται από δύο πρωτόνια και δύο νετρόνια. Στα δύο πρωτόνια οφείλεται το ηλεκτρικό φορτίο του (+2). Στα τέσσερα αυτά σωματίδια οφείλεται η μάζα του (τετραπλάσια της μάζας του πυρήνα υδρογόνου). Το ίδιο συμβαίνει και για όλους τους άλλους πυρήνες, με μοναδική εξαίρεση τον πυρήνα του υδρογόνου, που δεν είναι παρά ένα και μόνο πρωτόνιο. Έτσι, ο πυρήνας του ουρανίου αποτελείται από 92 πρωτόνια και 146 ηλεκτρόνια. Το ηλεκτρικό φορτίο του είναι, βέβαια, +92 αλλά η μάζα του είναι 238 (92+146) φορές μεγαλύτερη από τη μάζα του πρωτονίου.
Ο πυρήνας του ατόμου κάθε στοιχείου έχει, κατά κανόνα, έναν αυστηρά ορισμένο αριθμό πρωτονίων. Ο αριθμός, όμως, των νετρονίων μπορεί να μεταβάλλεται ελαφρά από άτομο σε άτομο του ίδιου στοιχείου. Κλασικό παράδειγμα είναι το ουράνιο, του οποίου μερικοί πυρήνες αποτελούνται από 92 πρωτόνια κι από, μόνο, 143 νετρόνια (αντί για 146). Έτσι, το φορτίο τους εξακολουθεί να είναι + 92 αλλά η μάζα τους είναι 235 (92 + 143) φορές μεγαλύτερη από τη μάζα του πρωτονίου.
Οι πυρήνες ενός στοιχείου που έχουν τον ίδιο αριθμό πρωτονίων αλλά διαφορετικό αριθμό νετρονίων λέγονται ισότοπα. Τα ισότοπα διακρίνονται και κατονομάζονται σύμφωνα με το συνολικό αριθμό των σωματιδίων του πυρήνα. Το ουράνιο με 92 πρωτόνια και 146 νετρόνια είναι το «ουράνιο-238». Το ισότοπο με 92 πρωτόνια και 143 νετρόνια είναι το «ουράνιο-235». Τα ισότοπα ενός στοιχείου δεν είναι το ίδιο διαδομένα στη φύση. Το ένα μπορεί να είναι πολύ συνηθισμένο ενώ το άλλο πολύ σπάνιο. Στην περίπτωση των ισοτόπων ουρανίου, σε κάθε 100 άτομα ουρανίου τα 993 είναι ουράνιο-238 ενώ μόνον 7 είναι ουράνιο-23531.
Όπως είπαμε παραπάνω, ένα πολύ σοβαρό μειονέκτημα στη χρήση των σωματιδίων α και των πρωτονίων, σαν βλήματα εναντίον πυρήνων, είναι το ότι έχουν θετικό ηλεκτρικό φορτίο. Ο ατομικός πυρήνας, είναι κι αυτός θετικά φορτισμένος. Επίσης ξέρουμε ότι δυο θετικά φορτία απωθούνται αμοιβαία όταν βρεθούν πολύ κοντά το ένα στο άλλο. Έτσι, όταν σωματίδια α ή πρωτόνια πλησιάζουν σε πυρήνα ένα μεγάλο μέρος της ταχύτητας τους χάνεται, εξαιτίας αυτής ακριβώς της άπωσης. Αυτός είναι ο λόγος που η αποτελεσματικότητα των πυρηνικών αντιδράσεων ήταν περιορισμένη ακόμη και με την χρήση των επιταχυντών.
Τι θα γινόταν αν χρησιμοποιούνταν νετρόνια; Τα νετρόνια δεν έχουν ηλεκτρικό φορτίο κι έτσι δεν έχουν να αντιμετωπίσουν την απωθητική δύναμη του πυρήνα. Θα μπορούσαν, όμως, τα νετρόνια να αποκτήσουν τόση μεγάλη ενέργεια ώστε να προκαλέσουν πυρηνική αντίδραση; Δεν πρέπει να ξεχνάμε ότι τα πρωτόνια επιταχύνονταν μέσα σε μαγνητικό πεδίο μόνο και μόνο επειδή ήταν ηλεκτρικά φορτισμένα. Αντίθετα, εφόσον τα νετρόνια δεν έχουν ηλεκτρικό φορτίο δεν μπορούν να επιταχυνθούν με τον ίδιο τρόπο32.
Ένα νέο δρόμο άνοιξε στα 1934, στη Ρώμη, ο Ιταλός επιστήμονας Ενρίκο Φέρμι (1901 – 1954) και η ομάδα του. Σκέφτηκε ότι, δεν ήταν ανάγκη να επιταχύνει τα νετρόνια, τουναντίον, έπρεπε να τα επιβραδύνει. Παρατήρησε ότι όσο πιο αργά κινούνται τα νετρόνια μιας εξωτερικής δέσμης τόσο πιο πιθανό είναι να διεισδύσουν στο εσωτερικό του πυρήνα και να να απορροφηθούν κατ’ αρχάς από αυτόν. Επομένως για να κάνει τα νετρόνια πιο αποτελεσματικά τα επιβράδυνε υποχρεώνοντάς τα να διασχίσουν νερό ή παραφίνη. Το νεόφερτο, τώρα, νετρόνιο θα μπορούσε να προκαλέσει μια αναστάτωση μέσα στην πυρήνα και να διαταράξει την ισορροπία πρωτονίων-ηλεκτρονίων με αποτέλεσμα να ξεκινήσει μόνος του ο πυρήνας να αντιδρά και να αναδιατάξει τα σωματίδια που περιέχει.

Ο Φέρμι, πραγματικά, άρχισε μια μεγάλη σειρά πειραμάτων στα οποία βομβάρδιζε πυρήνες με νετρόνια χαμηλής ταχύτητας. Σε πολλές περιπτώσεις διαπίστωσε, όπως είχε φανταστεί, ότι ο πυρήνας απορροφούσε ένα νετρόνιο και, αντιδρώντας από μόνος του, έκανε αναδιάταξη των σωματιδίων του και, μάλιστα, με τέτοιο τρόπο ώστε το νετρόνιο να γίνεται πρωτόνιο! Έτσι, στο τέλος, ο πυρήνας βρισκόταν με ένα πρωτόνιο παραπάνω από όσα είχε στην αρχή. Δηλαδή, με άλλα λόγια, δημιουργήθηκε ένα νέο στοιχείο, κατά έναν ατομικό αριθμό μεγαλύτερο από το παλιό. Ένα παράδειγμα των αποτελεσμάτων των πειραμάτων του Φέρμι είναι ο βομβαρδισμός πυρήνων του στοιχείου ρόδιο, με ατομικό αριθμό 45, και η δημιουργία του στοιχείου παλλάδιο, με ατομικό αριθμό 46. Ένα άλλο παράδειγμα, η μεταστοιχείωση του στοιχείου ίνδιο, με ατομικό αριθμό 49, σε κασσίτερο, με ατομικό αριθμό 50. Την εποχή εκείνη, το στοιχείο που είχε το μεγαλύτερο ατομικό αριθμό ήταν το ουράνιο (ατομικός αριθμός 92). Διερωτήθηκε, τότε, ο Φέρμι, αν θα μπορούσε, βομβαρδίζοντας πυρήνες ουρανίου με νετρόνια, να φτιάξει ένα νέο βαρύτερο στοιχείο με ατομικό αριθμό 93. Στοιχείο με τέτοιο ατομικό αριθμό δεν ήταν γνωστό να υπάρχει στη φύση κι ο Φέρμι θα μπορούσε με αυτόν τον τρόπο να δημιουργήσει κάτι πραγματικά νέο 33 .
Εν τούτοις, όταν ο Φέρμι και η ομάδα του βομβάρδισαν με νετρόνια τα στοιχεία θόριο και ουράνιο, αυτό που συνέβη δεν ήταν η παραγωγή βαρύτερων στοιχείων, όπως πίστευαν, αλλά το φαινόμενο της σχάσης το οποίο κανείς δεν θεωρούσε πιθανό εκείνη την περίοδο, αν και οι χημικοί Ίντα και Βάλτερ Νόντακ, δημοσίευσαν μια εργασία τους στο Zeitshrift fur Angewandte Chemie, υποστηρίζοντας ότι ο πυρήνας μπορεί αντίθετα να διασπαστεί σε ελαφρύτερα στοιχεία, αν και δεν παρουσίασαν συγκεκριμένο μηχανισμό για κάτι τέτοιο: « Μπορούμε λοιπόν να σκεφτούμε, ότι, στο βομβαρδισμό των βαρέων πυρήνων με νετρόνια, αυτοί οι πυρήνες θα σπάνε σε πολλά άλλα αρκετά μεγάλα κομμάτια, ισότοπα γνωστών στοιχείων, αλλά μη γειτνιάζοντα προς τ’ ακτινοβολούμενα στοιχεία» 34 . Αυτή είναι η πρώτη σαφής νύξη για πυρηνική σχάση. Δεν έγινε όμως δεκτή, ούτε εξετάστηκε σοβαρά, γιατί ερχόταν σε αντίθεση με την επικρατούσα τότε αντίληψη, ότι ήταν αδιανόητο ένα νετρόνιο με ελάχιστη κινητική ενέργεια να μπορεί να διασπάσει ένα τόσο στερεό κατασκεύασμα όσο ο πυρήνας που δεν έσπαγε ούτε κάτω από τον ανηλεή βομβαρδισμός των σωματιδίων α. Ούτε ο ίδιος ο Φέρμι δεν αναγνώρισε ότι μπορούσε να προκαλέσει το φαινόμενο της σχάσης χωρίς να το καταλάβει 35 .
Το αποφασιστικό βήμα έγινε στη ναζιστική Γερμανία στα τέλη του 1938. Οι ραδιοχημικοί Όττο Χαν και Φριτζ Στράσμαν στο Βερολίνο, συνεχίζοντας τα πειράματα βομβαρδισμού ουρανίου με νετρόνια, βρέθηκαν μπροστά σε παράδοξα ευρήματα. Ανάμεσα στα προϊόντα διάσπασης του ουρανίου ανίχνευσαν στοιχεία μέσης μάζας, όπως το βάριο (ατομικός αριθμός 56). Αυτό το αποτέλεσμα ήταν απρόσμενο: ένα τόσο μικρό σωματίδιο σαν το νετρόνιο δεν ήταν θεωρητικά ικανό να «σπάσει» τον τεράστιο πυρήνα του ουρανίου σε δύο περίπου ίσα θραύσματα. Κι όμως, αυτή φαινόταν να είναι η μόνη λογική ερμηνεία – ότι ο πυρήνας του ουρανίου είχε διασπαστεί σε μικρότερα κομμάτια αντί να παραμείνει σχεδόν ακέραιος δημιουργώντας ένα στοιχείο λίγο βαρύτερο 36 . «Φτάνουμε στο συμπέρασμα», έγραψαν αργότερα οι δύο Γερμανοί ραδιοχημικοί , «Τα ραδιοϊσότοπα μας έχουν τις ιδιότητες του βαρίου σαν χημικοί θα λέγαμε ότι μετά τον βομβαρδισμό του ουρανίου με νετρόνια δημιουργείται όχι ράδιο, αλλά βάριο … Σαν πυρηνικοί δεν μπορούμε ακόμα να αποφασίσουμε αυτό το άλμα: είναι αντίθετο με ό,τι ήταν γνωστό στην πυρηνική φυσική » 37 . Έτσι μέσα στο δισταγμό και την αμφιβολία άρχισε η εποχή της διάσπασης του πυρήνα.

Ο Ότο Χαν και η Λιζ Μάιτνερ στο εργαστήριο του Ινστιτούτου Emil Fischer, στο Πανεπιστήμιο του Βερολίνου
Η Λιζ Μάιτνερ (1878 – 1968), συνεργάτης του Χαν και κορυφαία πυρηνική φυσικός, ήταν η καταλληλότερη για να εξηγήσει το παράδοξο, αλλά λόγω της εβραϊκής της καταγωγής είχε μόλις διαφύγει από τη ναζιστική Γερμανία στη Σουηδία (Ιούλιος 1938). Ο Χαν της έστειλε τα αποτελέσματα. Κατά τη διάρκεια των Χριστουγεννιάτικων διακοπών, τη Μάιτνερ την επισκέφτηκε ο ανιψιό της, Όττο Φρις (1904 – 1979), επίσης φυσικός που εργαζόταν στην Κοπεγχάγη στο ινστιτούτο του Νιλς Μπορ (1885 – 1962) και μαζί προσπάθησαν να ερμηνεύσουν τα δεδομένα. Ήξεραν ότι ο Χαν ήταν καλός χημικός και δεν είχε κάνει λάθος, αλλά τα αποτελέσματα δεν έβγαζαν νόημα. Σκέφτηκαν να παρομοιάσουν τον πυρήνα με μια σταγόνα υγρού σύμφωνα με το μοντέλο του Νιλς Μπορ – ένα εύπλαστο σύνολο που μπορεί να ταλαντωθεί και να παραμορφωθεί. Υπό αυτή την οπτική, η πρόσθεση ενός νετρονίου θα μπορούσε να κάνει τον πυρήνα του ουρανίου να επιμηκυνθεί, να στενέψει στη μέση και τελικά να σπάσει στα δύο, όπως μια σταγόνα νερού που χωρίζεται. Πράγματι, τα θραύσματα που παράγονται ήταν πολύ πιο ελαφριά στοιχεία (π.χ. βάριο) και απελευθερώνονταν και μερικά νετρόνια. Η Μάιτνερ υπολόγισε ότι η μάζα των προϊόντων ήταν ελαφρώς μικρότερη (κατά περίπου 0,1% της αρχικής μάζας του ουρανίου) – η «εξαφανισμένη» αυτή μάζα, σύμφωνα με την εξίσωση E=mc² του Αϊνστάιν, αντιστοιχεί σε τεράστια ενέργεια (~200 MeV) που εκλύεται από κάθε πυρήνα. Όλα τα κομμάτια του παζλ ταίριαζαν πλέον: η διάσπαση του πυρήνα του ουρανίου εξηγούσε τόσο την εμφάνιση του βαρίου όσο και την έκλυση ισχυρής ραδιενέργειας και ενέργειας 38 .
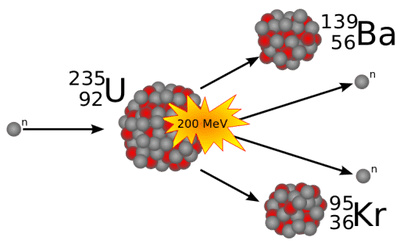
Η Μάιτνερ και ο Φρις είχαν ανακαλύψει ότι κάτι φαινομενικά αδύνατο ήταν εφικτό: ο ατομικός πυρήνας μπορεί να διαιρεθεί στα συστατικά του. Ο Φρις πρότεινε για αυτήν τη νέα πυρηνική διεργασία τον όρο «πυρηνική σχάση» («nuclear fission») – κατ’ αναλογία με τον βιολογικό όρο διχοτόμηση («binary fission») που περιγράφει τη διαίρεση των κυττάρων 39 . Οι Μάιτνερ και ο Φρις ανακοίνωσαν τα αποτελέσματα τους στον Νιλς Μπορ, ο οποίος βρισκόταν στην Κοπεγχάγη έτοιμος να αναχωρήσει για τις Ηνωμένες Πολιτείες μέσω Σουηδίας και Αγγλίας. Ο Μπορ επιβεβαίωσε την εγκυρότητα των ευρημάτων εν πλω προς τη Νέα Υόρκη, στην οποία έφτασε στις 16 Ιανουαρίου 1939. Δέκα ημέρες αργότερα, συνοδευόμενος από τον Ενρίκο Φέρμι, ανακοίνωσε τις τελευταίες εξελίξεις σε ορισμένους Ευρωπαίους επιστήμονες μετανάστες που είχαν προηγηθεί σε αυτή τη χώρα και σε μέλη της αμερικανικής επιστημονικής κοινότητας σε ένα συνέδριο για τη Θεωρητική Φυσική στην Ουάσιγκτον.
Η ανακάλυψη της σχάσης έγινε δεκτή με ενθουσιασμό και έκπληξη από τη διεθνή επιστημονική κοινότητα. Ο Χαν και ο Στράσμαν δημοσίευσαν ξεχωριστά τα πειραματικά ευρήματά τους στο τεύχος της 6ης Ιανουαρίου 1939 του περιοδικού Die Naturwissenschaften, χωρίς θεωρητική εξήγηση, ενώ η Μάιτνερ και ο Φρις δημοσίευσαν την ερμηνεία τους, στο τεύχος της 11ης Φεβρουαρίου 1939, του περιοδικού Nature, επιβεβαιώνοντας ότι είχε πραγματοποιηθεί διάσπαση του ατόμου σε ελαφρότερα στοιχεία.
Στο Πανεπιστήμιο Κολούμπια στη Νέα Υόρκη, ο Ενρίκο Φέρμι, διεξήγαγε το πρώτο πείραμα πυρηνικής σχάσης στις Ηνωμένες Πολιτείες στις 25 Ιανουαρίου 1939. Με αξιοσημείωτη ταχύτητα, οι θεωρητικοί φυσικοί ανέπτυξαν ένα πληρέστερο μοντέλο της σχάσης. Στις 5 Φεβρουαρίου ο Νιλς Μπορ συνειδητοποιεί ότι το ουράνιο-235 και το ουράνιο-238 πρέπει να έχουν διαφορετική ειδική σχάση, ότι το ουράνιο-238 θα μπορούσε να υποβληθεί σε σχάση από ταχεία νετρόνια αλλά όχι από αργά, και ότι το ουράνιο-235 ευθύνεται για την παρατηρούμενη αργή σχάση στο ουράνιο.
Σύντομα έγινε ξεκάθαρο ότι η διαδικασία της σχάσης είχε ένα ακόμη σημαντικό χαρακτηριστικό, εκτός από την άμεση απελευθέρωση τεραστίων ποσοτήτων ενέργειας. Αυτό ήταν η εκπομπή νετρονίων. Η ενέργεια που απελευθερωνόταν όταν συνέβαινε σχάση στο ουράνιο προκαλούσε τον «εξοστρακισμό» αρκετών νετρονίων από τα δύο κύρια θραύσματα, καθώς αυτά απομακρύνονταν το ένα από το άλλο. Τον Μάρτιο του 1939 οι Ενρίκο Φέρμι και Χέρμπερτ Άντερσον διαπίστωσαν ότι παράγονται περίπου δύο νετρόνια για κάθε νετρόνιο που καταναλώνεται στη σχάση. Στις 22 Απριλίου 1939 στη Γαλλία, ο Φρεντερίκ Ζολιό-Κιουρί και η ομάδα του δημοσίευσε τα αποτελέσματα των πειραμάτων τα οποία έδειχναν ότι η σχάση του ουρανίου ελευθερώνει κατά μέσο όρο 2 με 3 νετρόνια επιπλέον ανά πυρήνα που διασπάται. Το ίδιο παρατήρησε και ο Ουγγροαμερικανός φυσικός και εφευρέτης Λέο Σίλαρντ (1898 – 1964) που είχε ήδη, από το 1933, συλλάβει θεωρητικά την ιδέα της αλυσιδωτής πυρηνικής αντίδρασης που προκαλείται από νετρόνια (που λίγο πριν είχαν ανακαλυφθεί) και είχε κατοχυρώσει με δίπλωμα ευρεσιτεχνίας την ιδέα ενός αντιδραστήρα πυρηνικής σχάσης το 1934.
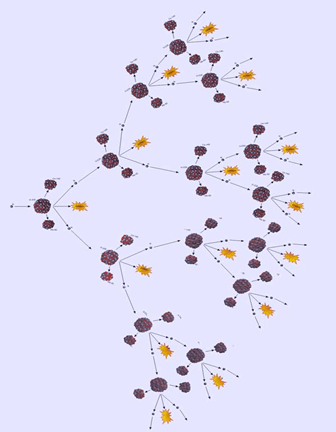
Η αλυσιδωτή αντίδραση είναι η σχάση των πυρήνων ενός ραδιενεργού υλικού που ανατροφοδοτείται από τα νετρόνια που εκλύονται από προηγούμενες σχάσεις πυρήνων του ίδιου υλικού. Πηγή: http://www.hellenica.de/Physik/AlysidotiAntidrasi.html
Υπό τις κατάλληλες συνθήκες, ίσως αυτά τα δευτερεύοντα νετρόνια μπορούσαν να συγκρουστούν με άλλα άτομα, απελευθερώνοντας επιπλέον νετρόνια, τα οποία με τη σειρά τους θα προσέκρουαν σε άλλα άτομα, ενώ ταυτόχρονα θα απελευθέρωναν συνεχώς ενέργεια. Ξεκινώντας από έναν μόνο πυρήνα ουρανίου, η σχάση θα μπορούσε όχι μόνο να παράγει σημαντικές ποσότητες ενέργειας, αλλά και να οδηγήσει σε μια αντίδραση που παράγει συνεχώς αυξανόμενες ποσότητες ενέργειας. Η πιθανότητα μιας τέτοιας αλυσίδας αντιδράσεων (αλυσιδωτής αντίδρασης) άλλαξε πλήρως τις προοπτικές για την απελευθέρωση της ενέργειας που ήταν αποθηκευμένη στον πυρήνα. Οι επιστήμονες αντιλήφθηκαν αμέσως τη διττή σημασία αυτού του φαινομένου. Από τη μια, αν η αντίδραση μπορούσε να ελεγχθεί, θα παρείχε έναν νέο τρόπο απελευθέρωσης πυρηνικής ενέργειας για ειρηνική χρήση (παραγωγή θερμότητας και ηλεκτρικής ενέργειας). Από την άλλη, αν η αντίδραση εξελισσόταν ανεξέλεγκτα, θα προκαλούσε μια τιτάνια έκρηξη – δηλαδή ένα νέο είδος βόμβας ανυπολόγιστης ισχύος. Δεν αποτελεί έκπληξη ότι εν μέσω των ζοφερών διεθνών εξελίξεων του 1939, πολλοί κορυφαίοι φυσικοί άρχισαν να σκέφτονται την πιθανότητα κατασκευής ενός πυρηνικού όπλου προτού προλάβει να το πράξει το αντίπαλο στρατόπεδο.
Συνεχίζεται
Σημειώσεις
- Οικονόμου Λ., 1991, σ. 22
- ΒΑΡΒΟΓΛΗΣ Χ., 2009, σ. 12
- Πάλι εκεί, σ. 10
- Το ξεκίνημα της σύγχρονης ατομικής θεωρίας, στο: Θέματα Ιστορίας της Χημείας. Βλ. http://molwave.chem.auth.gr/chemhistory/discovery_of_atom/1_4.html
- Πάλι εκεί
- BYNUM W., 2014, σσ. 271-272
- ΑΣΙΜΩΦ Ι., 1982, σ. 19
- Rhodes R., 1986, σ. 54
- Ραδιενέργεια ονομάζεται η ακτινοβολία η οποία εκπέμπεται κατά τη ραδιενεργό αποσύνθεση (διάσπαση) ασταθών πυρήνων (νουκλιδίων) προς σταθερούς πυρήνες. Η διάσπαση αυτή ακολουθείται από την εκπομπή σωματιδίων και (όχι πάντα) ηλεκτρομαγνητικής ακτινοβολίας. Τα σωματίδια και η ακτινοβολία συνιστούν τη ραδιενέργεια.
- Rhodes R., 1986, σ. 56
- Ο όρος που χρησιμοποιούσαν οι ερευνητές τότε δεν ήταν «μεταστοιχείωση» αλλά «μετασχηματισμός». Όταν ο Σόντυ, ανέφερε στον Ράδερφορντ τον όρο μεταστοιχείωση, ο τελευταίος του είπε μισοαστεία μισοσοβαρά: «Για όνομα του θεού, Σόντυ, μη το ξαναπείς μεταστοιχείωση. Θα μας αποκεφαλίσουν ως αλχημιστές».
- Οικονόμου Λ., 1991, σ. 28
- Πάλι εκεί, σσ. 28 – 29
- Πάλι εκεί, σ. 30
- Rutherford E., 1911. “The Scattering of α and β Particles by Matter and the Structure of the Atom.” Philosophical Magazine, Series 6, 21(125), 669–688.
- https://el.wikipedia.org/wiki/%CE%91%CF%84%CE%BF%CE%BC%CE%B9%CE%BA%CF%8C_%CF%80%CF%81%CF%8C%CF%84%CF%85%CF%80%CE%BF_%CF%84%CE%BF%CF%85_%CE%9C%CF%80%CE%BF%CF%81
- BYNUM W., 2014, σσ. 275 – 276
- Ατομικό πρότυπο του Μπορ στο: https://el.wikipedia.org/wiki/%CE%91%CF%84%CE%BF%CE%BC%CE%B9%CE%BA%CF%8C_%CF%80%CF%81%CF%8C%CF%84%CF%85%CF%80%CE%BF_%CF%84%CE%BF%CF%85_%CE%9C%CF%80%CE%BF%CF%81
- ΑΣΙΜΩΦ Ι., 1982, σ. 26
- Οικονόμου Λ., 1991, σσ. 36-37
- https://www.britannica.com/biography/Ernest-Rutherford/McGill-University
- https://en.wikipedia.org/wiki/Proton?utm_source=chatgpt.com
- Λίγο μετά την απόκτηση του βραβείου Νόμπελ, ο Ράδερφορντ έγραψε το λήμμα για τη ραδιενέργεια για την 11η έκδοση (1910) της Εγκυκλοπαίδειας Μπριτάνικα.
- Το φράγμα Κουλόμπ, που πήρε το όνομά του από το νόμο του Κουλόμπ, ο οποίος με τη σειρά του πήρε το όνομά του από τον φυσικό Σαρλ-Ωγκυστέν ντε Κουλόμπ, είναι το ενεργειακό φράγμα λόγω της ηλεκτροστατικής αλληλεπίδρασης που πρέπει να ξεπεράσουν δύο πυρήνες, ώστε να μπορούν να πλησιάσουν αρκετά για να υποστούν πυρηνική αντίδραση
- Ένα ηλεκτρονιοβόλτ (συμβολισμός: eV) αποτελεί μονάδα μέτρησης της ενέργειας, που χρησιμοποιείται κυρίως σε ατομικό και υποατομικό επίπεδο. Ένα (1) eV, εκφράζει το ποσό της κινητικής ενέργειας που αποκτά ένα μη δεσμικό ηλεκτρόνιο καθώς περνά από ηλεκτροστατική διαφορά δυναμικού ενός βολτ (V), στο κενό. Ένα MeV είναι 1 εκατομμύριο eV
- Γενικά επιταχυντής σωματιδίων ονομάζεται μια ειδική μηχανική διάταξη που μπορεί και επιταχύνει σωματίδια σε μεγάλες ταχύτητες, που μπορεί να φτάσουν ένα σημαντικό ποσοστό της ταχύτητας του φωτός. Στη πραγματικότητα ο επιταχυντής σωματιδίων επιταχύνει δέσμες φορτισμένων σωματιδίων (π.χ. πρωτονίων και ηλεκτρονίων) κατά μήκος μιας τροχιάς, χρησιμοποιώντας ηλεκτρικά και μαγνητικά πεδία. Όταν πλέον οι δέσμες των σωματιδίων αυτών αναπτύξουν πολύ μεγάλη ταχύτητα οδηγούνται σε σύγκρουση με άλλα σωματίδια καλούμενα σωματίδια στόχοι
- https://en.wikipedia.org/wiki/Ernest_Lawrence
- BIRD K. & SHERWIN M.J., 2008, σσ. 113 – 114
- https://en.wikipedia.org/wiki/Ernest_Lawrence
- Οικονόμου Λ., 1991, σ. 41
- ΑΣΙΜΩΦ Ι., 1982, σσ. 32 – 33
- Πάλι εκεί, σ. 51
- Alan Chodos. December 1938: Discovery of Nuclear Fission, APS News, Dec. 3, 2007. Στο: https://www.aps.org/apsnews/2007/12/december-1938-discovery-nuclear-fission
- Οικονόμου Λ., 1991, σ. 45
- https://www.osti.gov/opennet/manhattan-project-history/Events/1890s-1939/discovery_fission.htm
- Πάλι εκεί
- Οικονόμου Λ., 1991, σ. 45
- Alan Chodos. December 1938: Discovery of Nuclear Fission, APS News, Dec. 3, 2007. Στο: https://www.aps.org/apsnews/2007/12/december-1938-discovery-nuclear-fission
- https://www.iaea.org/newscenter/news/pioneering-nuclear-science-discovery-nuclear-fission
Βιβλιογραφία
ΑΣΙΜΩΦ Ι., 1982. ΠΩΣ ΒΡΗΚΑΜΕ ΤΗΝ ΠΥΡΗΝΙΚΗ ΕΝΕΡΓΕΙΑ. Αθήνα: Εκδόσεις ΠΑΝΕΠΙΣΤΗΜΙΑΚΟΣ ΤΥΠΟΣ Φ. ΚΑΪΑΦΑ & ΣΙΑ Ο.Ε.
ΒΑΡΒΟΓΛΗΣ Χ., 2009. ΙΣΤΟΡΙΑ ΚΑΙ ΕΞΕΛΙΞΗ ΤΩΝ ΙΔΕΩΝ ΣΤΗ ΦΥΣΙΚΗ
Baggott J., 2011. The First War of Physics: The Secret History of the Atom Bomb, 1939-1949. Publisher: Pegasus Books
BIRD K. & SHERWIN M.J., 2008. Ο ΘΡΙΑΜΒΟΣ ΚΑΙ Η ΤΡΑΓΩΔΙΑ ΤΟΥ ΡΟΜΠΕΡΤ ΟΠΕΝΧΑΪΜΕΡ. Αθήνα: Εκδοτικός Οίκος ΤΡΑΥΛΟΣ
BYNUM W., 2014. ΜΙΚΡΗ ΙΣΤΟΡΙΑ ΤΗΣ ΕΠΙΣΤΗΜΗΣ. Αθήνα: Εκδόσεις ΠΑΤΑΚΗ
Davenport K. & Kimball D. G., 2025. Nuclear Weapons: Who Has What at a Glance. Arms Control Association. https://www.armscontrol.org/factsheets/nuclear-weapons-who-has-what-glance
Gosling F.G., 2010. The MANHATTAN PROJECT. Making the Atomic Bomb. UNITED STATES DEPARTMENT OF ENERGY
Gaddis J.L., 2018. Ο ΨΥΧΡΟΣ ΠΟΛΕΜΟΣ. ΟΙ ΣΥΜΦΩΝΙΕΣ, ΟΙ ΣΥΓΚΡΟΥΣΕΙΣ, ΤΑ ΨΕΜΑΤΑ, ΟΙ ΑΛΗΘΕΙΕΣ. Αθήνα: Εκδόσεις ΠΑΠΑΔΟΠΟΥΛΟΣ
Groves L. R., 1962. Now It Can Be Told: The Story of the Manhattan Project. Publisher Harper & Row
Hewitt P. G., 1997. Οι Έννοιες της Φυσικής Τόμος II. Ηράκλειο: ΠΑΝΕΠΙΣΤΗΜΙΑΚΕΣ ΕΚΔΟΣΕΙΣ ΚΡΗΤΗΣ
Isaacson W., 8/15/2018. Einstein Helped Invent the A-Bomb, But He Watched Its Deployment in Horror. HISTORYNET. https://www.historynet.com/einstein-and-the-bomb/
Kelly C. C. (Ed), 2006. Oppenheimer and the Manhattan Project: Insights into J. Robert Oppenheimer, Father of the Atomic Bomb. Publisher: World Scientific Publishing Company
KERSHAW I., 2020. Η ΕΥΡΩΠΗ ΣΕ ΔΙΝΗ 1950 – 2017. Αθήνα: Εκδόσεις Αλεξάνδρεια
Kristensen H.M. & Korda M., 2025. World nuclear forces. SIPRI Yearbook 2025: Armaments, Disarmament and International Security www.sipriyearbook.org
Kunetka J., 2015. The general and the genius: Groves and Oppenheimer: the unlikely partnership that built the atom bomb. Washington, DC: Publisher Regnery Publishing
LaRue R., 6/12/2006. J. Robert Oppenheimer and America’s Quest Build an Atomic Bomb. https://www.historynet.com/weaponry-scientists-meet-at-berkeley-to-lay-foundation-to-build-an-atomic-bomb/
Mearsheimer J., 2011. Η ΤΡΑΓΩΔΙΑ ΤΗΣ ΠΟΛΙΤΙΚΗΣ ΤΩΝ ΜΕΓΑΛΩΝ ΔΥΝΑΜΕΩΝ. Αθήνα: Εκδόσεις ΠΟΙΟΤΗΤΑ
NORRIS R.S., Racing for the Bomb: General Leslie R. Groves, the Manhattan Project’s indispensable man. Publisher: STEERFORTH PRESS
Οικονόμου Λ., 1991. ΣΥΜΒΙΩΣΗ ΧΩΡΙΣ ΜΕΛΛΟΝ. ΠΥΡΗΝΙΚΑ ΟΠΛΑ ΚΑΙ ΑΝΘΡΩΠΙΝΟΣ ΠΟΛΙΤΙΣΜΟΣ. Ηράκλειο: ΠΑΝΕΠΙΣΤΗΜΙΑΚΕΣ ΕΚΔΟΣΕΙΣ ΚΡΗΤΗΣ
Poolos J., 2008. The Atomic Bombings of Hiroshima and Nagasaki (2008) [Great Historic Disasters]. Publisher: Chelsea House Publications
Rhodes R., 1986. The Making of the Atomic Bomb. New York: Publisher Simon & Schuster
Schweber S.S., 2008. ΣΤΗ ΣΚΙΑ ΤΗΣ ΒΟΜΒΑΣ. ΟΠΕΝΧΑΪΜΕΡ – ΜΠΕΤΕ. Η ΗΘΙΚΗ ΤΟΥ ΕΠΙΣΤΗΜΟΝΑ. Αθήνα: Εκδόσεις ΠΟΥΚΑΜΙΣΑΣ
Τραχανάς Σ., 2008. ΠΡΟΒΛΗΜΑΤΑ ΚΒΑΝΤΟΜΗΧΑΝΙΚΗΣ. Ηράκλειο: ΠΑΝΕΠΙΣΤΗΜΙΑΚΕΣ ΕΚΔΟΣΕΙΣ ΚΡΗΤΗΣ
Τραχανάς Σ., 2014. Μεγάλη επιστήμη ενδιαφέρουσες ζωές. ΟΙ ΠΡΩΤΑΓΩΝΙΣΤΕΣ ΤΗΣ ΚΒΑΝΤΙΚΗΣ ΕΠΑΝΑΣΤΑΣΗΣ. Ηράκλειο: ΠΑΝΕΠΙΣΤΗΜΙΑΚΕΣ ΕΚΔΟΣΕΙΣ ΚΡΗΤΗΣ & ΣΤΕΦΑΝΟΣ Λ. ΤΡΑΧΑΝΑΣ
Young J. W., 2006. Η Ευρώπη του Ψυχρού Πολέμου. 1945 – 1991: Πολιτική Ιστορία. Αθήνα: Εκδόσεις Πατάκη

Αυτή η εργασία χορηγείται με άδεια Creative Commons Αναφορά Δημιουργού-Μη Εμπορική Χρήση-Όχι Παράγωγα Έργα 4.0 Διεθνές .